- 인공지능 기반 유효 결합 판별 기술을 도입해 후보 물질 발굴의 정확도와 예측도를 높이고 타깃 단백질과 약물간 3차 구조 정보를 이용해 많은 양의 후보 성분들을 빠르고 정확하게 분석하고 결합 여부 예측 가능
- 향후 ‘엠토르’ 단백질 억제 및 자가포식 기반 신규 항암 치료제 개발과 임상에 적극 활용 기대

KAIST는 생명과학과 김세윤 교수 연구팀이 `약물 가상 스크리닝 기술을 이용한 신규 항암 치료제 개발'에 성공했다고 12일 밝혔다.
이번 연구 결과는 국제 학술지인 `세포 사멸과 질병(Cell Death & Disease)'에 지난 7월 12일 字 온라인 게재됐다.
※ 논문명: Lomitapide, a cholesterol-lowering drug, is an anticancer agent that induces autophagic cell death via inhibiting mTOR
※ 저자 정보: 이보아 (한국과학기술원, 공동 제1 저자), 박승주 (한국과학기술원, 공동 제1 저자), 이슬기 (한국과학기술원, 제2 저자), 오병철 (가천대학교 의과대학, 공동 저자), 정원석 (한국과학기술원, 공동 저자), 손종우 (한국과학기술원, 공동 저자), 김세윤 (한국과학기술원, 교신저자), 포함 총 10명
`엠토르(mTOR)'라고 알려진 신호전달 단백질은 많은 암세포에서 활성이 비정상적으로 높아져 있으며 또한 암뿐만 아니라 당뇨, 염증 및 노화와 같은 다양한 질병에서 핵심적인 역할을 한다. 특히 암을 유발하는 다양한 신호전달 경로가 엠토르 단백질을 통해 매개되기 때문에 많은 제약사에서 항암 치료제 개발의 목적으로 엠토르 저해제 개발에 많은 투자를 하고 있다.
자가포식(autophagy, 오토파지)으로 알려진 생명 현상은 세포 내 엠토르 단백질에 의해 활성 조절이 정교하게 매개되는 것으로 잘 알려져 있다. 자가포식이란 `세포가 자기 살을 먹는다'는 의미로, 영양분이 과도하게 부족하거나 세포 내외적 스트레스 조건에 처한 경우, 세포가 스스로 내부 구성물질들을 파괴해 활용함으로써 세포 내 항상성을 유지하는 일종의 방어기전이다.
이러한 자가포식 활성의 조절은 양날의 칼과 같이 작용하는 것으로 알려져 있으며, 이는 암, 당뇨와 같은 질환의 발생 및 치료에 이용 가능하다고 주목받고 있다. 암세포에 과도하게 활성화돼있는 엠토르 단백질의 활성을 저해하면 자가포식을 과도하게 증가시킬 수 있으며 이를 통해 암세포의 세포 사멸이 유도될 수 있다는 사실이 알려져 있으며 이를 바탕으로 자가포식 강화에 기반한 항암제 약물의 개발전략이 제시되고 있다.
이에 김세윤 교수 연구팀은 단백질의 3차원적 구조를 활용해 화합물과 표적 단백질 사이의 물리적 상호작용을 모델링하는 유효 결합 판별 기술에 기반한 약물 재창출 전략으로 엠토르 억제성 항암제 개발 연구를 수행했다.
약물 재창출은 이미 안전성이 검증된 FDA 승인 약물 또는 임상 진행 중인 약물군을 대상으로 새로운 적응증을 찾는 신약 개발 방식이다. 이 전략은 전통적으로 10년 이상 소요되는 신약 개발의 막대한 시간과 투자를 혁신적으로 단축할 수 있는 미래 시대 신약 개발전략이다.
연구팀은 FDA 승인 약물 또는 임상 시험 중인 약물에 기반한 데이터베이스를 통해 3,391종의 약물 라이브러리를 활용했다. 라이브러리의 모든 약물을 실험적으로 검증하기에는 연구비용과 시간이 많이 소요되므로, 3차 구조 모델링을 통한 유효 결합 판별 기술을 적용해 엠토르 활성 저해능력을 보이는 약물만 신속하게 스크리닝했다.
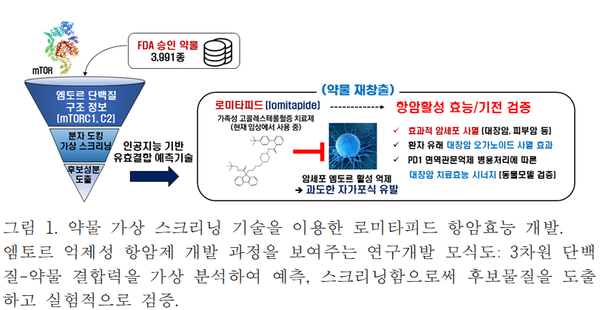
연구팀은 엠토르 단백질의 활성을 담당하는 효소 활성부위의 3차 구조 분석과 인공지능 기반 유효 결합 판별 기술을 도입해 후보 물질 발굴의 정확도와 예측도를 높이는 데 성공했다. 그리고 3차 구조를 타깃으로 약물 결합 분석 모듈을 도입해 가상 스크리닝의 정확도와 예측도를 높이는 데 성공했다. 이번 연구를 통해 개발된 기술의 가장 큰 특징은 타깃 단백질과 약물 간의 3차 구조 정보를 이용해 많은 양의 후보 성분들을 빠르고 정확하게 분석하고 결합 여부를 예측할 수 있는 것이다.
KAIST 생명과학과 이보아 박사, 박승주 박사는 현재 가족성 고콜레스테롤혈증(familial hypercholesterolemia) 치료제로서 임상에서 판매, 활용되고 있는 로미타피드(lomitapide) 약물의 엠토르 활성 억제 가능성을 예측했다. 연구팀은 생화학적 및 세포 생물학적 분석을 통해 로미타피드에 의한 엠토르 효소활성의 억제효능을 검증하는 데 성공했다. 대장암, 피부암 등의 암세포에 로미타피드를 처리할 경우, 암세포의 엠토르 활성이 효과적으로 억제되고 이후 과도한 자가포식이 유도됨으로써 암세포 사멸효과가 발생함을 다각적으로 확인해 로미타피드의 항암 효능을 확립했다.
또한 대장암 환자로부터 유래한 암 오가노이드(organoid)에 로미타피드를 처리할 경우, 기존의 화학 항암 치료제 대비 우수한 암세포 사멸 능력을 보였다. 나아가 최근 차세대 고형암 치료용 항암 전략으로 주목받고 있는 면역관문억제제(immune checkpoint inhibitor)와 로미티피드를 병행할 경우, 면역관문억제제의 단독 처리 대비 비약적으로 개선된 시너지 항암효과를 나타냄을 동물모델 연구를 통해 검증하는 데 성공했다.
연구팀이 발굴한 로미타피드의 항암 효능 성과는 향후 엠토르 억제 및 자가포식 기반 항암제 개발 및 임상적 활용에 적극 활용될 것으로 기대된다.
이러한 연구성과는 벤처창업으로 연계돼 이보아 박사, 박승주 박사, 이슬기 박사는 인공지능 기반 신약개발 전문기업 `에아스텍'을 공동창업했으며 중소벤처기업부 팁스(TIPS) 창업지원 프로그램에 선정되는 등 활발한 연구개발을 수행하고 있다.
한편 이번 연구는 한국연구재단 중견연구자지원사업, 선도연구센터, 창의도전연구사업 및 KAIX 포스트닥펠로사업의 지원을 받아 수행됐다.