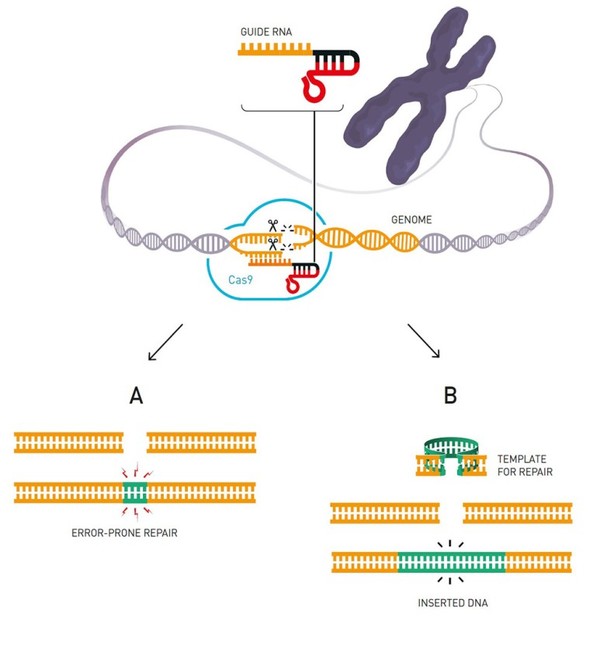
10월 7일 노벨위원회는 2020 노벨화학상 공동수상자로 제니퍼 다우드나 미국 버클리캘리포니아대(UC버클리) 교수와 에마뉘엘 샤르팡티에 독일 막스플랑크연구소 단장을 선정했다고 발표했다. 이들은 유전자 가위인 CRIPSR-Cas9(크리스퍼-캐스9) 작동원리를 시험관 실험으로 규명해 새로운 유전체교정 기법 개발에 기여한 공로를 인정받았다. 100년이 넘는 노벨상 역사에서 여성의 수상이 몇 차례 있었지만, 남성을 배제하고 여성만으로 과학 부문 수상자가 결정된 것은 처음이라고 한다. 이 글을 통해 수상자들의 업적을 살펴보고 이 분야의 국내 연구동향을 소개한다.

CRISPR는 세균의 DNA에 보편적으로 존재하는 규칙적, 반복적인 염기서열을 일컫는 용어다. 1987년 일본 오사카대의 나카다 교수팀이 최초로 우연히 발견했다. 이후 프란시스코 모지카 스페인 알리깐떼대 교수를 포함한 여러 연구자들이 미생물이 바이러스를 물리치기 위해 가지고 있는 면역체계임을 규명했다. 즉 세균 세포가 파아지라고 불리는 세균 특이적 바이러스에 감염되면 대부분 세균은 죽지만, 일부는 살아 남아 바이러스의 DNA 일부를 잘라 자신의 유전체에 차곡차곡 삽입한다. 바로 이 부분이 CRISPR(Clusters of Regularly Inter-Spaced Palindromic Repeats)이다. CRISPR 영역은 RNA로 전사되고 잘게 쪼게 진 후 세포 내 Cas9 단백질과 결합해 RNA-단백질 복합체를 형성한다. 같은 바이러스가 다시 그 세균에 침입하면, CRISPR-Cas9 복합체가 바이러스 염기서열을 인식해 결합한 후 절단해 세포를 보호한다.
샤르팡티에 교수는 CRISPR-Cas9 복합체에 기존의 crRNA(크리스퍼RNA) 이외에 tracrRNA가 존재함을 알아냈다. 그리고 이 tracrRNA가 CRISRP 영역이 전사된 후 여러 개의 crRNA로 쪼개지는 데 결정적 역할을 한다는 사실을 최초로 규명했다. CRISPR 작동기작의 퍼즐을 푸는 단초를 제공한 것이다.
당시 비정규직으로 유럽의 여러 연구소를 떠돌던 무명 과학자였던 샤르팡티에는 2011년 미국미생물학회에서 다우드나 교수를 만난다. 이는 두 사람 모두에게 큰 행운이 되었다. 이미 구조생물학 및 생화학 분야의 세계적 대가였던 다우드나 교수는 샤르팡티에의 연구성과가 가지는 의미와 중요성에 주목해 공동연구를 시작했다. 이듬해 6월, 이들은 crRNA와 tracrRNA의 주요 부위를 연결해 single guide RNA(sgRNA)를 만들 수 있고 Cas9-sgRNA 복합체가 시험관에서 sgRNA와 상보적 염기서열을 지닌 표적 DNA를 절단할 수 있음을 입증했다(Science 논문 게재). 나아가 이를 이용하면 인간세포를 비롯한 진핵세포의 유전체 염기서열을 맞춤 교정할 수 있을 것이라고 제안했다.
미생물학자들의 CRISPR 기능 연구와 별개로, 1990년 이래 일부 유전학자, 생화학자들은 진핵세포의 유전체 염기서열에 맞춤 변이를 도입하는 유전체교정(genome editing) 기법을 개발하고자 했다. 생명체에 있어 DNA 염기서열은 대대손손 이어받는 숙명 같은 것이다. 이를 맞춤 교정할 수 있다면, 유전자 기능 규명은 물론 유전질환, 암 등 다양한 난치병 치료에도 활용할 수 있게 된다.
대표적으로 다나 캐롤 미국 유타대 교수팀은 맞춤형 유전자가위 ZFN(zinc finger nuclease·징크핑거핵산분해효소)를 개발해 초파리의 특정 유전자 염기서열을 절단하면, 그 절단부위가 세포내 수선기작에 의해 변이가 일어날 수 있음을 최초 입증했다.
다만 매번 새롭게 맞춤 ZFN을 만드는 것이 쉽지 않았다. 2010년대 초까지만해도 이 획기적 실험기법을 활용하는 실험실은 전 세계에서 서너 개에 불과했다. CRISPR-Cas9은 맞춤 단백질을 만들 필요 없이 RNA만 교체하면 되기 때문에 ZFN의 대안으로 주목받았다. 그러나 세균 세포 내에서 CRSPR-Cas9이 표적 염기서열을 인식해 절단할 수 있다고 해서, 바로 진핵세포 DNA에도 적용 가능할지는 불확실했다. 진핵세포 유전체 DNA는 세균 세포 DNA와는 달리 히스톤이라는 단백질과 강력히 결합하고 있다. 또한 돌돌 말리고 접혀서 크로마틴이라는 콤팩트한 구조를 이룬다. 세균 세포 내에서 naked DNA을 인식하고 절단하도록 진화된 CRISPR-Cas9을 진핵세포에 인위적으로 도입한다고 해서, 과연 크로마틴과 히스톤을 풀어 헤치고 표적 DNA 염기서열을 인식해 절단할 수 있을지는 불분명했다.
하지만 놀랍게도, CRISPR-Cas9은 인간배양세포에서 유전체 DNA를 인식해 절단하고 그 위치에 맞춤 변이를 유도할 수 있음이 여러 실험실에서 독립적으로 입증되었다. 그 결과 2013년 1월, 미국 연구팀 세 곳과 서울대 연구팀이 관련 논문을 각각 발표했다. 이후 불과 수년 만에 전 세계 수많은 생명과학 실험실에서 CRISPR-Cas9이 인간배양세포는 물론이고 다양한 동물, 식물, 미생물의 유전자 교정 도구로 널리 사용되었다. 이를 두고 2010년대 초반까지 소수 연구자들만 과점하던 유전체교정 기법이 CRISPR-Cas9에 의해 민주화되었다고 평하기도 한다.
인간을 비롯한 생명체의 DNA를 고쳐 쓰게 해주는 CRISPR-Cas9은 생명과학 실험실 내 혁명을 넘어섰다. 특히 신약개발과 동식물 생명공학 분야에 막대한 영향을 미치고 있다. 미국, EU, 중국에서는 이미 CRISPR-Cas9을 이용해서 다양한 유전질환, 혈액암 환자 치료를 위한 임상시험이 진행 중이다. 병충해에 강한 동식물, 장기이식에 적합한 돼지도 개발되었다. 다만 아직 이들 유전자 교정 동식물 중에 안정성, 환경유해성 평가를 마치고 판매 허가된 사례는 없다. 심지어 2018년 10월, 중국에서는 후천성면역결핍증(AIDS)을 초래하는 인간면역결핍바이러스(HIV)에 감염되지 않도록 HIV 수용체에 변이를 유도한 쌍둥이가 출산되기도 했다. 과학계는 적절한 규제와 사회적 합의 없이 CRISPR 기술이 인간 유전자 변형에 사용된 것에 규탄과 우려를 표명했다.
필자는 1994년 미국 위스콘신대 박사학위 과정 중 우연히 당시 존스홉킨스대의 스리니바산 찬드라세가란 교수팀이 ZFN을 개발하고 있다는 사실을 알게 되었다. 이를 계기로 ZFN의 기초가 되는 맞춤 zinc finger 단백질 개발 가능성을 제시한 매사츄세츠공대(MIT)의 칼 페이보 교수 연구실에 박사후연구원으로 참여하면서 이 분야에 발을 들였다. 1997년 말 귀국하여 대기업과 창업회사에서 zinc finger 단백질 연구를 계속하였고, 2005년 서울대 화학부 교수 임용 후 ZFN 관련 본격적인 연구를 수행했다. 특히 ZFN으로 유전체 두 곳을 동시에 자르면 대규모 결실, 역위 등 유전체 재배열을 유도할 수 있음을 처음 확인하여, 중증 A형 혈우병의 원인이 되는 유전자 역위를 원상복구시킬 수 있음을 보였다.
그러나 맞춤 ZFN을 만드는 것이 여전히 어려웠기 때문에 항상 대안을 찾고 있었다. 특히 2008년경부터 매주 저널클럽을 통해 수십 편의 CRISPR 관련 논문을 공부하면서 이 분야에 주목했다. 그 결과 2013년 1월, CRISPR-Cas9을 유전자가위로 활용해 인간배양세포의 특정 유전자에 맞춤 변이를 유도할 수 있다는 내용의 논문을 Nature Biotechnology에 발표했다. 이로써 소위 ‘CRISPR 혁명’에 동참하게 되었다.
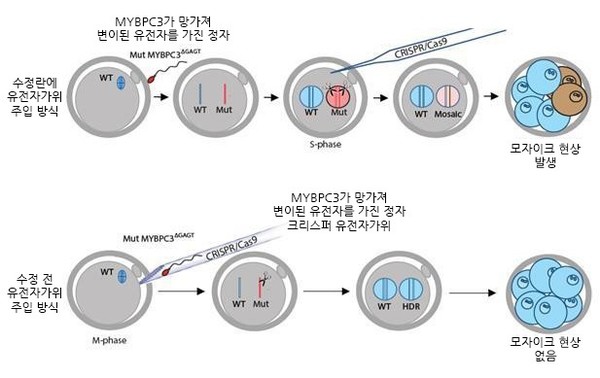
2014년에는 IBS 유전체교정 연구단장으로 임명되어 주로 CRISPR-Cas9의 정확성 개선 및 표적이탈효과 측정 연구를 수행했다. 몇 가지 예를 들어보고자 한다. 배상수 박사(현 한양대 화학과 교수)가 개발한 Cas-OFFinder는 CRISPR-Cas9의 표적 염기서열과 유사한 서열을 찾아 주는 컴퓨터 프로그램이다. 전 세계에서 하루에도 수 백 명이 IBS/한양대 서버에 접속해 이를 사용하고 있다. 김대식 박사(현 한국생명공학연구원 전임연구원)가 개발한 Digenome-seq은 실제 실험을 통해 유전체 상에 존재하는 CRISPR-Cas9의 오프타겟을 확인하는 방법으로 학계의 큰 주목을 받았다. 김소정 박사(현 미국 NIH 연구원)는 Cas9을 플라즈미드 DNA가 아닌 단백질 형태로 세포에 도입해 유전자교정을 할 수 있음을 최초로 보고하였다. 이 방법은 표적이탈효과를 크게 줄일 수 있어서 항암 치료용 면역세포 개발 등에 활용되고 있다. 표적이탈효과를 측정하고 제어하는 이러한 방법들은 해외 연구진 두 곳과의 인간배아 유전자교정 공동연구에도 활용되었다(2017년 Nature 논문 2편 게재). 최근 들어 연구단은 DNA를 자르지 않고 유전자 변이를 도입하는 새로운 유전체교정 기법 연구에 주력하고 있다. DNA가 너무 여러 곳에서 잘리면 세포 독성이 초래될 수 있고 원치 않는 변이가 일어날 수 있기 때문이다.
CRISPR-Cas9은 기초과학이 우리 사회와 인류의 미래에 지대한 영향을 미칠 수 있음을 보여 준다. 미생물학자의 단순한 호기심에서 발견된 CRISPR가 난치병 치료제 개발과 우리 주변의 동식물 개량에도 활용되고 있다. 이를 통해 제약산업은 물론 농축산업 및 수산업 발전에 기여하고, 나아가 환경과 에너지 분야에도 큰 파급효과가 기대된다. 수십억 년에 걸친 진화의 산물인 인간이 이제 생명체 진화의 설계자가 된 것이다. 물론 이에 따르는 책임도 더욱 막중해졌다. 샤르팡티에와 다우드나는 CRISPR-Cas9의 작동원리를 규명하여 노벨상을 받을 자격이 차고 넘친다. 하지만 CRISPR 미생물학과 유전체교정 분야에 기여한 많은 선구자들의 업적도 함께 기억해야 한다. 이제 샤르팡티에, 다우드나라는 거인의 어께 위에서 더 멀리 내다 볼 차례다.
▣ 참고문헌
1. Ishino et al. J. Bacteriol. 169, 5429 (1987).
2. Mojica et al. J. Mol. Evol. 60, 174 (2005).
3. Deltcheva et al. Nature 471, 602 (2011).
4. Jinek et al. Science 337, 816 (2012).
5. Bibikova et al. Science 300, 764 (2003).
6. Mali et al. Science 339, 823 (2013).
7. Cong et al. Science 339, 819 (2013).
8. Cho et al. Nat. Biotechnol. 31, 230 (2013).
9. Jinek et al. eLife 2, e00471 (2013).
10. Cyranoski & Ledford. Nature 563, 607 (2018).
11. Kim, Y.-G. et al. Proc. Natl. Acad. Sci. USA 93, 1156 (1996).
12. Lee et al. Genome Res. 22, 539 (2012).
13. Bae et al. Bioinformatics 30, 1473 (2014).
14. Kim, D. et al. Nat. Methods 12, 237 (2015).
15. Kim, S. et al. Genome Res. 24 1012 (2014).
16. Ma et al. Nature 548, 413 (2017).
17. Forgarty et al. Nature 550, 67 (2017).
[출처] 과학자가 본 노벨상_vol.3 노벨화학상편(https://www.ibs.re.kr/cop/bbs/BBSMSTR_000000000991/selectBoardArticle.do?nttId=19163) | 작성자 IBS
김진수 유전체 교정 연구단 수석연구위원

유전자가위 분야의 세계적인 권위자이다. 위스콘신-매디슨대학교에서 박사학위를 받았으며, 서울대학교 화학과 교수로 재직 중이다. 현재 IBS 유전체교정 연구단에서 유전자가위 기법을 활용한 돌연변이 교정 및 난치성 질환 원천치료를 연구하고 있다.